近日,我校中药学院张彤/丁越团队在国际期刊ACS Applied Materials & Interfaces上发文CD44-Targeted Photoactivatable Polymeric Nanosystem with On−Demand Drug Release as a "Photoactivatable Bomb" for Combined Photodynamic Therapy−Chemotherapy of Cancer,开发并报道了一种新型CD44靶向的光激活释放纳米递药系统用于化疗和光动力疗法协同抗肿瘤研究。该研究成果为癌症协同治疗提供了新的思路和方向,也为中药抗肿瘤活性成分的增效减毒抗肿瘤研究提供了有力工具。

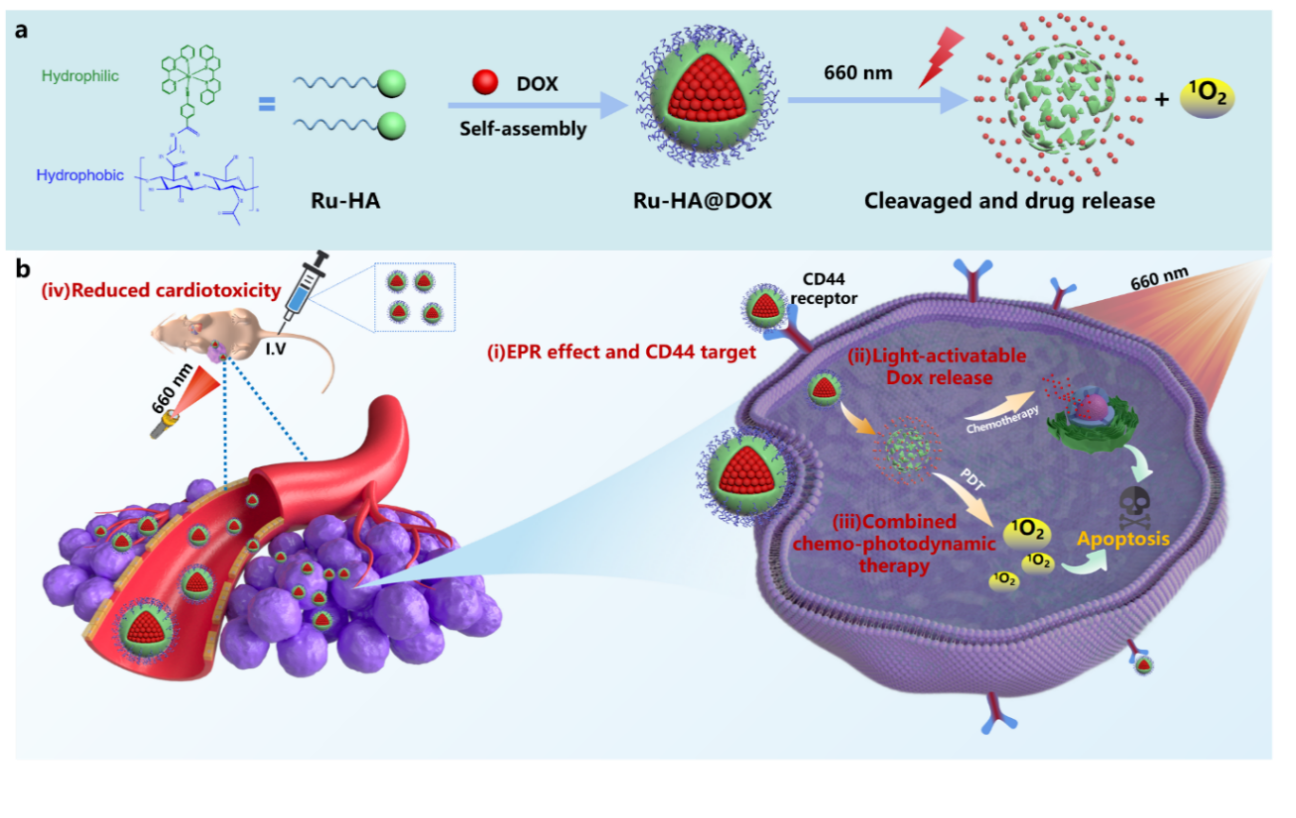
近年来,化疗、光疗及中药活性成分等联合治疗因其强效抗肿瘤作用备受关注。然而,如何实现联用药物的按需释放和减少毒副作用仍是抗癌药物研发和临床应用中的巨大挑战。针对该难题,课题组首次开发了一种具有光响应按需释药特性的两亲性材料Ru-HA,该材料由具有光裂解和光动力治疗能力(Photodynamic theraphy, PDT)的钌配合物(疏水端)与具有CD44受体靶向能力的生物相容性材料透明质酸HA(亲水端)构成。以临床阿霉素为模型药物,成功制备了多功能载药纳米制剂Ru-HA@DOX NPs,实现化疗-PDT协同抗肿瘤。
该纳米系统具有以下优点:通过EPR效应诱导的被动靶向和由HA介导的CD44受体主动靶向增强制剂在肿瘤部位的聚集。易于合成并具有良好的生物相容性,可调节光敏剂和药物的比例以实现个性化癌症治疗。Ru-HA@DOX NPs可通过近红外光响应裂解释放DOX同时产生1O2在肿瘤部位产生光动力治疗。联合化疗-光动力疗法达到更高效的肿瘤抑制效果,并减少了常规化疗药物的用量与副作用。研究团队目前已将该纳米递药系统用于中药抗肿瘤活性成分蟾蜍内酯、重楼皂苷和紫杉醇的抗肿瘤制剂研究,提高其肿瘤靶向性和抗肿瘤活性。
论文第一作者为我校兰金帅高级实验师及博士研究生曾瑞峰,张彤教授与丁越研究员为共同通讯作者,上海中医药大学为论文第一通讯单位。该研究得到国家自然科学基金、上海市青年优秀学术带头人计划、上海市曙光计划、上海市人才发展基金等项目的资助和支持。(科技处、中药学院)

