近日,上海中医药大学首席教授徐宏喜及团队成员席志超副研究员在Journal of Experimental & Clinical Cancer Research发表题为Osteoblasts and osteoclasts: an important switch of tumour cell dormancy during bone metastasis的综述文章。文章总结了破骨细胞和成骨细胞在癌症骨转移过程中调控肿瘤休眠的作用机制,为靶向休眠期癌细胞预防癌症转移提供了新的研究思路。

图1. 首席教授徐宏喜团队发表的综述文章
肿瘤转移是一个复杂且漫长的过程,由于骨髓中丰富的营养物质,绝大部分的播散肿瘤细胞(Disseminated tumour cells, DTCs)都有向骨转移的倾向。为了适应骨表面恶劣的生理条件和复杂的骨微环境,大部分转移到骨的DTCs会选择进入肿瘤休眠(Tumour cell dormancy)的状态。在这个过程中,维持骨稳态的两种重要的细胞:成骨细胞(Osteoblasts)和破骨细胞(Osteoclasts)起到关键调控作用。研究发现,成骨细胞调控的骨形成(Bone formation)可以与肿瘤细胞直接结合来诱导DTCs进入休眠,也可以通过释放各种生长因子(如OPN,Gas6,BMP7,Wnt5a等)来维持DTCs的肿瘤细胞休眠状态(图2)。

图2. 成骨细胞调控的骨形成诱导并维持肿瘤细胞休眠
破骨细胞则可以通过调控骨吸收(Bone resorption)促进休眠的肿瘤细胞激活,导致骨转移的发生(图3)。因此,临床上抗骨吸收的治疗药物,如双磷酸(bisphosphonate)和地诺单抗(denosumab)等,可以通过抑制骨吸收诱导的休眠期肿瘤细胞激活,进而抑制骨转移。值得一提的是,休眠的肿瘤细胞可以通过一系列信号通路,反向调控成骨细胞和破骨细胞,并利用它们维持休眠状态或再次激活。另外,许多炎症因子也参与了骨形成和骨吸收调控的肿瘤休眠过程;一系列关于DTCs与造血干细胞(haematopoietic stem cells, HSCs)竞争成骨细胞微环境,从而进入休眠状态的研究也被逐渐揭示。
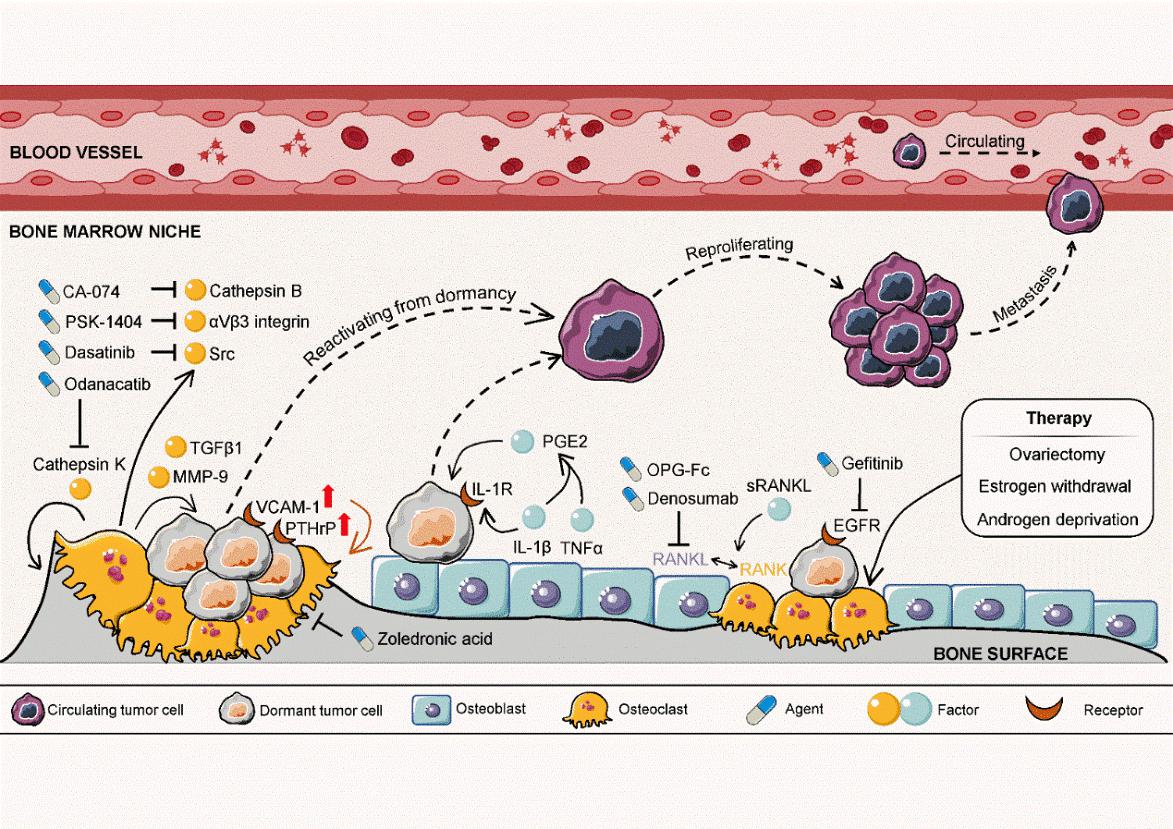
图3. 破骨细胞调控的骨吸收重新激活休眠的肿瘤细胞
课题组博士研究生戴榕辰和刘梦璠为论文的共同第一作者,徐宏喜首席教授与席志超副研究员为共同通讯作者。该研究工作得到国家自然科学基金、广东省重点领域研发计划等资助。
肿瘤的转移和复发是导致癌症患者死亡的主要原因,也是一直以来困扰癌症研究的瓶颈问题。肿瘤休眠和再激活机制在肿瘤的转移和复发过程中发挥了重要的促进作用。我校徐宏喜首席教授与席志超副研究员带领的研究团队专注于静止期癌细胞(休眠肿瘤细胞)存活与激活的关键靶点鉴定及药物发现,提出靶向静止期癌细胞预防肿瘤复发转移的治疗策略。研究团队已建立静止期癌细胞分子机理研究与药物研发的实验方法及动物模型,鉴定了数个调控静止期癌细胞激活的关键分子机制,发现了多个具有抑制静止期癌细胞激活的先导化合物。相关研究成果已发表于Nature Communications,Cell Death & Disease,Cancer Letters等国际著名期刊,授权多项发明专利,为预防癌症复发和转移的中药小分子药物研发提供了新思路与新方法。(中药学院)

