近日,我校附属龙华医院贾立军团队在权威学术期刊Signal Transduction and Targeted Therapy发表了题为Regulation of SKP2 protein stability by heat shock protein 90 chaperone machinery的研究论文,该研究揭示了促癌蛋白SKP2泛素连接酶受HSP90分子伴侣调控,而靶向抑制HSP90抗肿瘤治疗会介导SKP2的蛋白酶体降解。鉴于HSP90和SKP2在多种人类肿瘤中显著高表达、并与肿瘤发生发展密切相关,该研究揭示了一种SKP2的上游调控新机制以及靶向HSP90下调SKP2的抗肿瘤治疗新策略,并为靶向HSP90-SKP2通路抗癌中药单体筛选提供了新靶标。

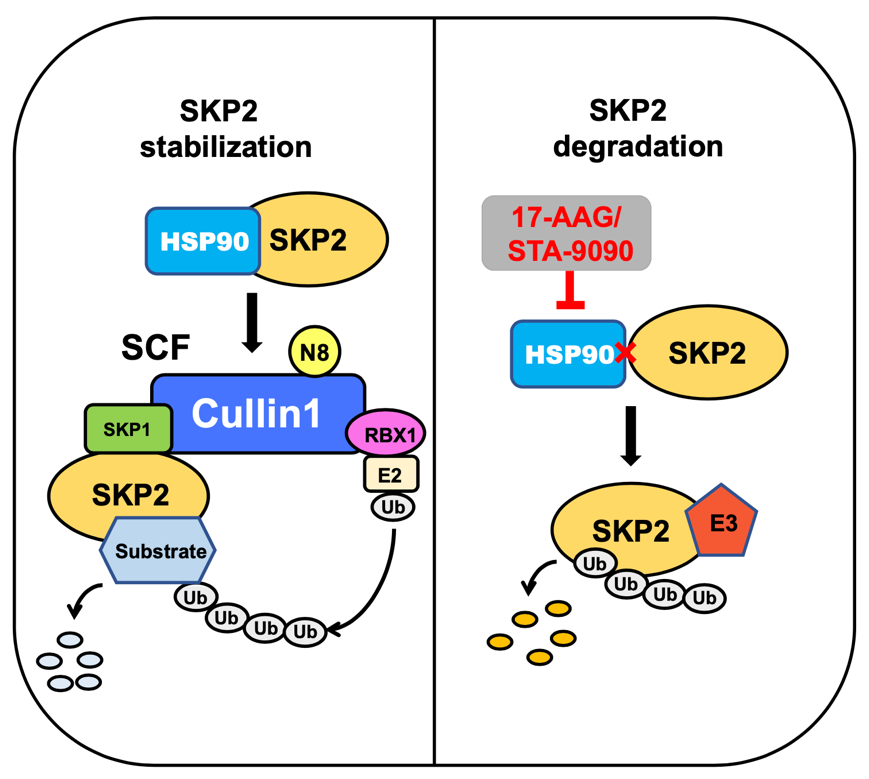
SKP2(S期激酶相关蛋白2)是SCFSKP2泛素连接酶复合物中重要的底物识别蛋白,能够靶向多种抑癌蛋白底物进行泛素化降解。研究表明,SKP2在多种肿瘤中高表达,促进肿瘤发生发展,是一个重要的抗癌治疗分子靶点。热休克蛋白90(HSP90)分子伴侣系统在维持蛋白质稳态中发挥重要的调控作用,能够结合并稳定多种具有促癌作用的“客户蛋白”,从而在多种肿瘤中发挥促癌作用。
该研究发现,目前已处于临床试验研究阶段的HSP90小分子抑制剂(17-AAG和STA-9090)在体内外均会导致SKP2蛋白表达下调,进而导致SKP2下游底物抑癌蛋白p27显著积累。机制上,HSP90抑制剂引起的SKP2蛋白下调是由于诱导了SKP2的泛素化修饰与降解。进一步研究发现,HSP90能够直接结合SKP2并调节其稳定性。在肿瘤样本中,HSP90和SKP2的蛋白表达呈现正相关,表明肿瘤中过表达的HSP90有助于稳定SKP2的表达,从而发挥促癌功能。
综上所述,该研究不仅揭示了一种新的SKP2肿瘤内高表达的调控机制,而且为通过研发中西医来源HSP90-SKP2抑制剂进行抗肿瘤治疗提供了科学依据。
龙华医院贾立军研究员为本文的通讯作者。龙华医院蔡丽丽博士与李立辉博士为本文的共同第一作者。(科技处、龙华医院)

